 » Barrierefreie Ansicht
» Barrierefreie Ansicht
| ||||||||
 | ||||||||
 |
 |
 |
| Nachlese zum 1. Herz-Kreislauf-Netz MeetingDownloadsArchivExterne Stellenangebote Klinik/Forschung |
 |
Funktionelle Genomik der kardialen Schädigung bei Hypertonie
 |
Teilprojektleiter
Prof. Dr. Martin Paul
Charite; Universitätsmedizin Berlin / Campus Benjamin Franklin
Institut für Klinische Pharmakologie und Toxikologie
Abteilung Klinische Pharmakologie
Hindenburgdamm 30
12200 Berlin
email: paul@medizin.fu-berlin.de
Tel: 030-8445 1701
Im Rahmen dieses Projektes werden die molekularen Mechanismen und funktionellen Effekte des Renin-Angiotensin-Aldosteron-Systems (RAAS) und des Kallikrein-Kinin-Systems (KKS) untersucht. Unser Forschungsprogramm teilt sich in drei komplementäre Themenbereiche auf.
Thema 1
Rolle des zirkulierenden bzw. lokalen Aldosterons beim hypertensiven kardialen Schaden.
In zweifach transgenen Ratten die die Gene des humanen Renin und Angiotensinogens (dTGR) überexprimieren, konnten wir erfolgreich Genexpressionsprofile im Herzen und in CD4+-Zellen mit Hilfe von Mikroarrays analysieren. In der Vergangenheit haben wir in zwei Studien die Rolle des Mineralkortikoidrezeptors (MR) in diesem Modell untersucht (Mazak 2004) und behandelten die zweifach transgenen Ratten (dTGR) mit Spironolacton und Eplerenon. Beide MR-Blocker führten zu einer Verbesserung des renalen und kardialen Schadens (Abb.1).
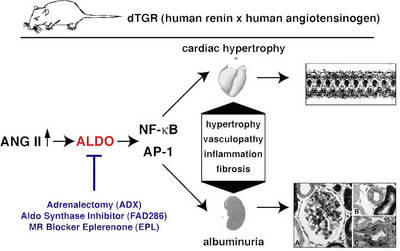 |
Abb. 1 Schema des dTGR Rattenmodells |
In jüngster Zeit haben wir verschiedene Studien in dTGR Ratten durchgeführt, um die Rolle des Aldosteron Signalweges bei kardialen und renalen Schäden zu untersuchen (Fiebeler et al. 2005; Pilz et al. 2005 und Shagdarsuren et al. 2005) und bestimmten Genexpressionsprofilen bei dTGR Ratten die eine Kachexie und terminale Herzinsuffizienz entwickelten (Wellner et al. 2005).
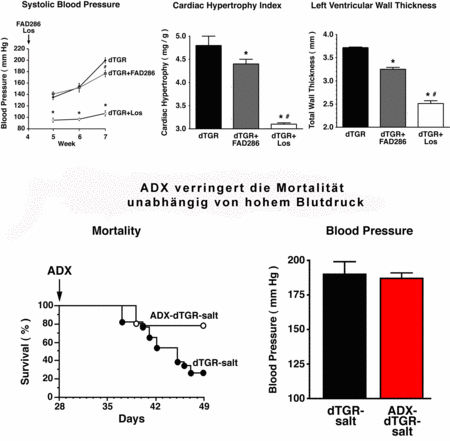 |
Abb. 2 Bedeutung des Aldosterons bei Endorganschäden |
Unsere Arrayexperimente zeigten, dass Gene der mitochondrialen Atmungskette und des Lipidkatabolismus in ihrer Expression reduziert wurden, während Gene die für Transkriptionsfaktoren (CEBP-beta, c-fos, Fra-1), Koagulation, Remodeling/ Reparaturkomponenten (HSP70, HSP27, Hämoxygenase), Immunsystem (Komplementkomponenten, IL-6), und für metabolische Signaltransduktionswege differenziell exprimiert wurde. Eine Behandlung der doppeltransgenen Ratten (dTGR) mit Losartan veränderte die Genexpressionsprofile zu denen die normalerweise bei Spragueu- Dawley Ratten beobachtet wurde.
Wir haben nun mit der Analyse von Ratten begonnen, die nach Myokardinfarkt und Adrenalektomie mit einem Aldosynthasehemmer behandelt wurden.
Referenzen:
1. Brand-Herrmann SM, Kopke K, Reichenberger F, Schmidt-Petersen K, Reineke T, Paul M, Zidek W, Brand E. Angiotensi-nogen promoter haplotypes are associated with blood pressure in untreated hypertensives. J Hypertens. 2004 Jul;22(7):1289-97
2. Tschope C, Spillmann F, Rehfeld U, Koch M, Westermann D, Altmann C, Dendorfer A, Walther T, Bader M, Paul M, Schultheiss HP, Vetter R. Improvement of defective sarcoplasmic reticulum Ca2+ transport in diabetic heart of transgenic rats expressing the human kallikrein-1 gene. FASEB J. 2004 Dec;18(15):1967-9.
3. Baltatu O, Campos LA, Bader M. Genetic targeting of the brain renin-angiotensin system in transgenic rats: impact on stress-induced renin release. Acta Physiol Scand. 2004 Aug;181(4):579-84.
4. Campos LA, Couto AS, Iliescu R, Santos JA, Santos RA, Ganten D, Campagnole-Santos MJ, Bader M, Baltatu O. Differential regulation of central vasopressin receptors in transgenic rats with low brain angiotensinogen. Regul Pept. 2004 Jul 15;119(3):177-82.
5. Pompe S, Bader M, Tannert C. Stem-cell research: the state of the art. Future regulations of embryonic-stem-cell research will be influenced more by economic interests and cultural history than by ethical concerns. EMBO Rep. 2005 Apr;6(4):297-300.
6. Wellner M, Dechend R, Park JK, Shagdasuren E, Al-Saadi N, Kirsch T, Gratze P, Schneider W, Meiners S, Fiebeler A, Haller H, Luft FC, Muller DN. Cardiac Gene Expression Profile in Rats with Terminal Heart Failure and Cachexia. Physiol Genomics. 2005;18:256-67.
7. Fiebeler A, Nussberger J, Shagdarsuren E, Rong S, Hilfenhaus G, Al-Saadi N, Dechend R, Wellner M, Meiners S, Maser-Gluth C, Jeng AY, Webb RL, Luft FC, Muller DN: An aldosterone synthase inhibitor ameliorates angiotensin II-induced organ damage. Circulation 2005;111:3087-94
8. H. Scholz, K.M. Kirschner. A role fort he Wilms¿ tumor protein WT1 in organ development. Physiology 20: 54-59, 2005.
9. Kamkin A, Kiseleva I, Lozinsky I, Scholz H. Electrical interaction of mechanosensitive fibroblasts and myocytes in the heart. Basic Res Cardiol. 2005 Jul;100(4):337-345.
10. Pilz B, Shagdarsuren E, Wellner M, Fiebeler A, Dechend R, Gratze P, Meiners S, Feldman DL, Webb RL, Garrelds IM, Danser AHJ, Luft FC, Müller DN: Aliskiren, a human renin inhibitor, ameliorates cardiac and renal damage in double transgenic rats. Hypertension 2005 in press.
11. Xu J, Carretero OA, Sun Y, Shesely EG, Rhaleb NE, Liu YH, Liao TD, Yang JJ, Bader M, Yang XP. Role of the B1 kinin re-ceptor in the regulation of cardiac function and remodeling after myocardial infarction. Hypertension. 2005 Apr;45(4):747-53.
12. Mazak I et al. Aldosterone potentiates angiotensin II-induced signaling in vascular smooth muscle cells. Circulation 2004;109:2792-2800.
Thema 2
Kardioprotektive Mechanismen von Kikin in transgenen Ratten
Wir haben ein transgenes Rattenmodell etabliert, das das Gewebe-Kallikrein hauptsächlich im Herzmuskel exprimiert und wir konnten zeigen, dass diese Tiere vor kardialer Hypertrophie und Fibrose geschützt sind (Pinto et al. 2000, Tschöpe et al. 2004a, 2004b, 2005).
Zur weiteren Aufklärung der Mechanismen, die an den kardioprotektiven Effekten des KKS beteiligt sind, haben wir ein transgenes Rattenmodell generiert, das den Kinen B2-Rezeptor hauptsächlich in Kardiomyozyten überexprimiert (Abb. 3).
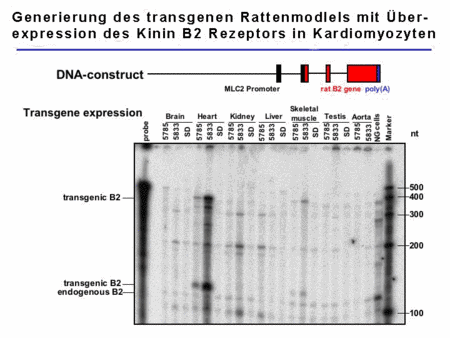 |
Abb.3. Charakterisierung der TGR(MLC2B2) Ratten |
Diese Tiere zeigten eine stark erhöhte Reaktion auf Bradykinin im Langendorff-Herz, eine verbesserte kardiale Funktion und waren auch vor diabetisch-induzierter LVH geschützt (Abb. 4, Bader et al., bisher unveröffentlicht).
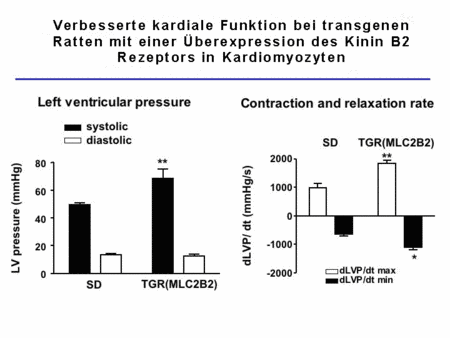 |
Abb.4 Kardiale Funktion in TGR(MLCB2) Ratten |
Wir haben begonnen, bei diesen Ratten LVH und kardiale Fibrose nach experimenteller Druck- (BPO) und Volumenüberlastung durch „aortic banding“ bzw. aortocavalen shunt zu induzieren. Um eine hypertensive Herzerkrankung zu erzeugen, werden die Tiere derzeit mit hypertensiven TGR (mRen)27) Ratten gekreuzt.
Bei doppelt transgenen Ratten werden der Blutdruck mittels Telemetrie und die LVH durch Echokardiographie, Morphologie und Genexpressionsanalysen bestimmt. Veränderungen im kardialen Genexpressionsprofil durch die transgene Überexpression des B2 Rezeptors werden durch Mikroarray-Expressionsanalysen in unbehandelten TGR (MLCB2) Ratten und bei Tieren nach LVH-Induktion bestimmt, um die „downstream“ Effektoren des Kallikrein-Kinin-Systems bei der Kardioprotektion zu bestimmen.
Referenzen:
1. Pinto YM et al., Increased kallikrein expression protects against cardiac ischemia. FASEB J. 2000;14, 1861-1863.
2. Tschöpe C et al, Improvement of defective sarcoplasmic reticulum Ca2+ transport in diabetic heart of transgenic rats expressing the human kallikrein-1 gene. FASEB J. 2004a;18,1967-1969.
3. Tschöpe C et al., Prevention of cardiac fibrosis and left ventricular dysfunction in diabetic cardiomyopathy in rats by transgenic expression of the human tissue kallikrein gene. FASEB J. 2004b;18, 828-835
4. Tschöpe C et al., Inhibition of intramyocardial inflammation, endothelial dysfunction and oxidative stress in experimental diabetic cardiomyopathy by transgenic activation of the kallikrein-kinin system. FASEB J. 2005, in press
Thema 3
Physiologische Genomik der Blutdruckvariabilität kardialer Schäden bei renovaskulärem Hochdruck.
Wir konnten bereits zeigen, dass BPO einen starken Anstieg der Natriumexkretion hervorruft und eine frequenzabhängige Hemmung des Renin-Systems bei frei laufenden Tieren hervorruft (Nafz et al. 2000). Dieser antihypertensive Effekt wird hauptsächlich durch Veränderungen der Plasma-Renin Aktivität, der renalen mRNA Menge, der renalen Proteinmenge und teilweise auch durch Veränderungen des renalen Protein/mRNA Verhältnisses hervorgerufen. Der letztere Effekt weist darauf hin, dass translationale Mechanismen eine bedeutende Rolle bei der BPO-abhängigen Hemmung des Renin-Systems und dadurch auch bei den mit dem renovaskulären Hochdruck zusammen hängenden Endorganschäden, spielen.
Wir konnten gleichermaßen zeigen, dass spezifische zelluläre Proteine mit dem 3`-UTR der Renin mRNA interagieren und somit einen Signalweg etablieren, der die in vivo Synthese des Renins reguliert.
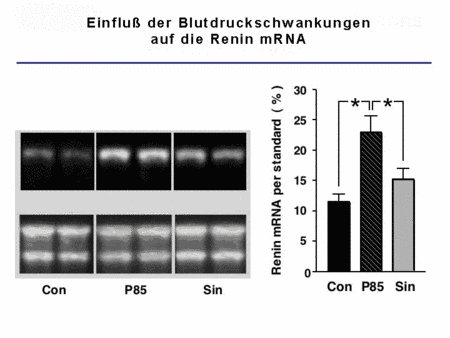 |
Abb. 5: Zusammenhang zwischen Blutdruckschwankungen und Renin-Expression |
Wir haben nun mit der Untersuchung begonnen, in welchem Umfang die BPO den kardialen Reninumsatz, als einen der Hauptdeterminanten der kardialen Hypertrophie und der kontraktilen Dysfunktion, moduliert und die kardiale Vaskulogenese (Wagner et al. 2002), sowie spezifische Zielgene die bei BPO differenziell exprimiert werden, beeinflusst oder induziert. Die Techniken der kontrollierten und transienten Ischämie, BPO und verschiedener Grade der renovaskulären Hypertension bei frei laufenden Ratten und Mäusen, wurden etabliert.
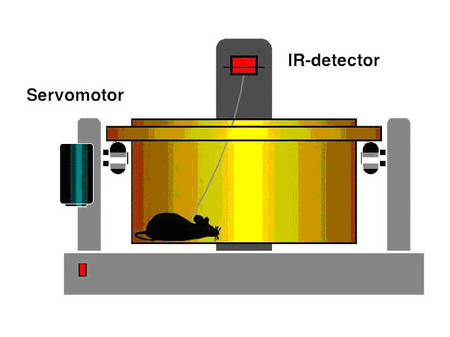 |
Abb. 6 Schema der Methode |
Wir haben mit der Untersuchung und Validierung der Einflüsse neuer Kandidatengene für kardiale Endorganschäden, der BPO und spezieller Formen der renovaskulären Hypertension begonnen.
Referenzen:
1. Wagner K et al. The Wilms' tumor suppressor Wt1 is expressed in the coronary vasculature after myocardial infarction. FASEB J. 2002;16(9):1117-9.
2. Nafz B et al. Antihypertensive effect of 0.1-Hz blood pressure oscillations
to the kidney. Circulation. 2000;101(5):553-7
Informationen zum Klinikum finden Sie unter:
http://www.charite.de/kliphatox/index_0.html